sábado, 5 de febrero de 2022
LA VENENOSA PÍLDORA COVID DE PFIZER
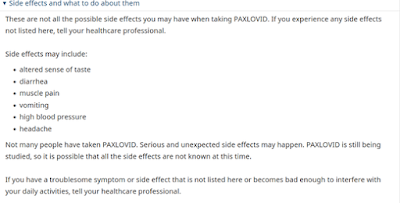
El Paxlovid de Pfizer se está extendiendo por todo el mundo. Pero en cierto modo es aún más experimental que la inyección anticovid de la compañía farmacéutica. El Ministerio de Sanidad de Canadá, al igual que la FDA de EE.UU., aliada de la industria farmacéutica desde hace décadas, admite que "no muchas personas han tomado Paxlovid. Pueden producirse efectos secundarios graves e inesperados".
Hablamos de un conjunto de píldoras para la covid, y es la segunda parte de un golpe de efecto que comenzó con la inyección de ARNm anticovid de la empresa. Juntos, están impulsando a Pfizer a niveles vertiginosos de beneficios y capitalización bursátil.
Sin embargo, es poco probable que estas píldoras produzcan "pax" (palabra latina para paz). El Paxlovid se ha probado en muy pocas personas hasta ahora. No se ha estudiado en absoluto en personas vacunadas o que hayan tenido covid. Las píldoras interactúan negativamente con muchos medicamentos muy utilizados. Además, por supuesto, los estudios están siendo manipulados para producir resultados aparentemente favorables.
He oído que, entre bastidores, algunos empleados de las agencias reguladoras están hartos de ceder a la intensa presión de los políticos, los funcionarios de salud pública y las grandes farmacéuticas. No quieren que los ciudadanos tomen este conjunto de píldoras extremadamente mal estudiadas y potencialmente muy peligrosas.
Cada dosis de Paxlovid consta de un comprimido de ritonavir, un antiguo medicamento anti-VIH reutilizado, y dos de un nuevo fármaco llamado nirmatrelvir. Ambos medicamentos son inhibidores de la proteasa.
La combinación nirmatrelvir/ritonavir fue autorizada por la Administración de Alimentos y Medicamentos de EE.UU. en virtud de una autorización de uso de emergencia (EUA) el 22 de diciembre de 2021, y por el Ministerio de Salud de Canadá el 17 de enero de 2022.
Además, se está aprobando rápidamente en otros países: por ejemplo, recibió el visto bueno en Israel el 26 de diciembre de 2021, en Corea del Sur el 27 de diciembre de 2021, en el Reino Unido el 31 de diciembre de 2021 y en Francia el 21 de enero de 2022.
Está permitida en jóvenes a partir de 12 años y en adultos en Estados Unidos, Israel y Corea del Sur. En otros países, como el Reino Unido y Canadá, está autorizada para mayores de 18 años.
Observe que la autorización no es una aprobación; es una evaluación muy rápida seguida del visto bueno para que decenas de millones de personas lo tomen, porque supuestamente estamos en una crisis de salud pública sin precedentes, similar a una guerra.
Además, una prueba en una placa de Petri realizada por científicos de Pfizer demostró que puede tener algún efecto sobre ómicron (véase el primer párrafo de la página 36 de la hoja de especificaciones canadiense del 22 de enero, conocido como monografía del producto) sobre el mismo. Basándose en estas escasas pruebas, los principales medios están informando ampliamente de que "se espera que las píldoras sean eficaces contra la ómicron".
Las píldoras de nirmatrelvir/ritonavir están siendo autorizadas para su uso por parte de las personas que dan positivo en la prueba de covid, tienen síntomas leves o moderados y se considera que están "en alto riesgo de progresión a Covid-19 grave".
Pero ¿cómo define Pfizer el alto riesgo?
Tener 60 años o más. O tener sobrepeso. O tener la presión arterial alta. O una serie de otras cosas, incluyendo tener "otras condiciones o factores (es decir, la raza o el origen étnico) que pueden colocar a los pacientes en alto riesgo de progresión" (véase la página 8 de la hoja de especificaciones canadiense del 22 de enero).
Se trata de una definición extremadamente amplia.
Otro hecho alarmante es que las decisiones estadounidenses y canadienses de autorizar nirmatrelvir/ritonavir se basaron únicamente en los análisis provisionales de un estudio en curso. Este ensayo comenzó el 25 de agosto de 2021 y está previsto que finalice aproximadamente el 24 de abril de 2022.
En total, sólo unas 1.000 personas habían sido barajadas para recibir nirmatrelvir/ritonavir en el momento en que las autoridades estadounidenses y canadienses le dieron el visto bueno.
Es muy difícil averiguar cuáles son las cifras concretas: tanto el comunicado de prensa de Pfizer del 5 de noviembre de 2021, que describe el análisis provisional examinado por la FDA, como la monografía del producto canadiense del 17 de enero de 2022 (que tiene un análisis provisional de una fecha ligeramente posterior) tienen un rango de cifras, así como varios tipos de análisis de datos.
Además, sólo el 13% de ese pequeño número eran personas de 65 años o más, y sólo el 3% tenían 75 años o más (véase la sección 1.2, titulada "Geriatría", en la página 4 de la monografía del producto canadiense de Paxlovid de 17 de enero de 2022).
Además, incluso esos resultados provisionales se manipularon al máximo en la redacción del estudio (más sobre esto a continuación), que en el caso de los Estados Unidos fue simplemente un comunicado de prensa de Pfizer de 5 de noviembre de 2021.
Pfizer ni siquiera hizo públicos los datos originales que suministró al Ministerio de Salud de Canadá, por lo que puedo determinar. Además, el comunicado de prensa de la compañía del 17 de enero de 2022 en el que se anunciaba la autorización en Canadá tenía muy pocos detalles.
Todo era muy predecible
Esto es obvio por el hecho de que más de un mes antes de la autorización de la FDA (el 18 de noviembre de 2021) el gobierno de EE.UU. firmó un acuerdo de 5.300 millones de dólares para 10 millones de ciclos de nirmatrelvir/ritonavir (es decir, 530 dólares por ciclo), a la espera de la autorización de la FDA.
Lo mismo ocurre en Canadá: el 3 de diciembre de 2021 el gobierno canadiense anunció su compromiso de comprar a Pfizer un millón de ciclos iniciales de nirmatrelvir/ritonavir, a la espera de la autorización del Ministerio de Salud de Canadá. Esto supone unos 690 millones de dólares canadienses si se hacen las cuentas sobre la base de 530 dólares estadounidenses por ciclo (un "ciclo" significa el número total de dosis necesarias para completar un régimen de tratamiento).
El mismo anuncio decía que el gobierno canadiense también había firmado un acuerdo con Merck para comprar 500.000 ciclos de la píldora anticovid de Merck, el molnupiravir, con opciones para comprar 500.000 ciclos más, también pendiente de la autorización del Ministerio de Salud de Canadá. El molnupiravir fue autorizado por la FDA de EE.UU. poco después, el 23 de diciembre de 2021, a pesar de las importantes preocupaciones. Entre ellas, su escasa eficacia, su elevada toxicidad y la posibilidad de que las mujeres que lo tomen durante el embarazo den a luz a niños con defectos congénitos. La FDA autorizó a Merck a venderlo para personas de 18 años o más con covid leve a moderada que den positivo y tengan un "alto riesgo" de desarrollar covid grave. El Ministerio de Salud de Canadá aún no le ha dado el visto bueno. Y los medios informan de que otros países también se están arrepintiendo.
Hay más. Por ejemplo, el nirmatrelvir/ritonavir no ha sido probado en absoluto en personas que no han sido vacunadas y no han tenido covid. A pesar de ello, se encuentran entre las personas que las autoridades quieren que sean las primeras en recibirlo.
Tampoco se ha probado en absoluto en mujeres embarazadas o en periodo de lactancia.
Pfizer afirma en la página 12 de la monografía del producto que Paxlovid "no debe utilizarse en embarazadas a menos que los beneficios potenciales superen los riesgos potenciales para el feto".
Pero no hay ninguna advertencia de este tipo para el uso de nirmatrelvir/ritonavir por parte de las mujeres en periodo de lactancia.
Como he señalado antes en este artículo, cada dosis de Paxlovid consta de dos comprimidos de nirmaltrelvir y un comprimido de ritonavir. Cada juego de tres comprimidos debe tomarse dos veces al día durante cinco días, empezando en los cinco días siguientes al inicio de los síntomas.
El ritonavir se utiliza desde 1996 en personas que dan positivo en la prueba del VIH. Es ampliamente conocido por causar afecciones graves y potencialmente mortales, como pancreatitis, problemas del ritmo cardíaco, problemas hepáticos, erupciones cutáneas graves y reacciones alérgicas.
Sin embargo, el nirmatrelvir/ritonavir no se ha estudiado en personas con insuficiencia hepática. Y ni Pfizer ni las autoridades gubernamentales advierten de que el nirmatrelvir/ritonavir no debe ser tomado, por ejemplo, por personas con riesgo de desarrollar una función hepática anormal (incluidas las que han tenido hepatitis B, hepatitis C o resultados elevados en las pruebas de función hepática).
En su lugar, están poniendo en primera línea a los ancianos y a los que viven en la pobreza o están desfavorecidos por otros motivos.
Un artículo de CBC News del 25 de enero informa de que el subdirector de salud pública de Canadá, Howard Njoo, recomienda que "las personas inmunodeprimidas, de 80 años o más, o [aquellas] que no tengan acceso a la atención sanitaria por motivos geográficos o socioeconómicos[,] sean los primeros en recibirlas, independientemente de su estado de vacunación".
Quebec es uno de los primeros lugares preparados para empezar a utilizarla en estas personas vulnerables. Para marzo esperan recibir suficientes pastillas para tratar a más de 25.000 personas. Eso incluye a los que tienen "enfermedades graves que no pueden ser vacunados". Después de eso, abrirán la lista a otros.
Por lo tanto, parece que los políticos, los funcionarios del gobierno y Pfizer están alimentando la demanda utilizando el mismo libro de jugadas que hicieron con las vacunas.
Sólo están poniendo a disposición un número relativamente pequeño de píldoras al principio.
Y los principales medios de comunicación están ayudando a darle bombo. Por ejemplo, un solo informe de la CBC realizado por la periodista de Montreal Verity Stevenson el 18 de enero lo calificó como un fármaco "codiciado" que ha sido "alabado por su potencial para reducir las hospitalizaciones por el virus" a través de la información de Pfizer de que "Paxlovid redujo el riesgo de hospitalización o muerte en un impresionante 89% en comparación con un placebo".
Y aquí hay otro ejemplo de la muy positiva cobertura general; está en el Toronto Star del 26 de enero:
Un artículo del National Post del 25 de enero de 2022 es en cierto modo una excepción: el autor, Tom Blackwell, señala el problema de que el Paxlovid interfiere con los efectos de otros medicamentos (más sobre esto a continuación). Sin embargo, no menciona la mayoría de los demás inconvenientes importantes de las píldoras.
Sin embargo, incluso el gobierno federal canadiense admite, en su página web para el público en general sobre la píldora, que "no muchas personas han tomado Paxlovid. Pueden producirse efectos secundarios graves e inesperados". El Paxlovid todavía se está estudiando, por lo que es posible que no se conozcan todos los efectos secundarios en este momento" [las negritas son mías].
Y más abajo en esa misma página dice que la gente debe informar de cualquier sospecha de efectos secundarios directamente al Ministerio de Salud de Canadá.
Desgraciadamente, sin embargo, sabemos por los escasos informes de efectos graves y muertes de, por ejemplo, las inyecciones anticovid, que es muy poco probable que los federales cuenten fielmente y muestren públicamente todos esos informes.
Por su parte, la FDA pidió a Pfizer que le informara de "los efectos adversos graves y todos los errores de medicación asociados al uso de Paxlovid", como parte de la EUA. También estipuló que los centros de salud y los proveedores de atención sanitaria que reciban Paxlovid harán un seguimiento y comunicarán los acontecimientos adversos graves y los errores de medicación. Sin embargo, es muy poco probable que esto dé lugar a una información pública completa y honesta.
La FDA también ha pedido a la empresa que le proporcione más resultados del ensayo relacionados con la seguridad y la eficacia hasta que el estudio concluya en abril.
Así que ni siquiera intentan fingir que se ha demostrado que es seguro y eficaz.
Después de todo, estamos en la época del farmacoceno de la historia de nuestro planeta.
Aquí hay tres banderas rojas más entre las muchas que rodean al Paxlovid: La FDA de EE.UU. omitió el importante paso de obtener la opinión de un panel asesor antes de dar una autorización de uso de emergencia al Paxlovid. Ese panel se llama Comité Asesor de Medicamentos Antimicrobianos. Los miembros del panel examinan los datos de las compañías farmacéuticas sobre los medicamentos que las empresas quieren aprobar. Las reuniones del panel son públicas y a ellas asisten los medios de comunicación y otras personas.
En cambio, en el caso del molnupiravir se convocó, a finales de noviembre de 2021 [los miembros votaron a favor, 13 a 10, y el 23 de diciembre de 2021, la FDA lo autorizó].
Lo descubrí cuando me topé con un artículo de SonsOfLibertyMedia.com del 6 de enero de 2022 sobre el Paxlovid. El artículo describe, entre otras muchas informaciones, este otro artículo del 22 de diciembre de 2021 de Bloomberg Law sobre la controversia causada por la FDA al saltarse este importante paso.
Las reuniones del panel suelen ser un mero trámite, pero sin embargo saltárselo es muy inusual.
Además de ser un inhibidor de la proteasa, el ritonavir reduce la actividad de una enzima muy importante llamada CYP3A4. El CYP3A4 se produce en el hígado. Allí, es fundamental para metabolizar (es decir, descomponer) un gran número de fármacos y toxinas; esto es necesario antes de que los fármacos y las toxinas puedan ser eliminados del organismo.
Dado que el ritonavir (y, por extensión, el Paxlovid) reduce la actividad del CYP3A4, esto significa que ese gran número de fármacos y toxinas permanecerán largo tiempo en el organismo.
El sitio web del gobierno federal canadiense sobre el Paxlovid admite que "muchos medicamentos interactúan con el Paxlovid. Tomar Paxlovid con estos medicamentos puede provocar efectos secundarios graves o potencialmente mortales" [las negritas son mías].
En total, hay más de 100 medicamentos que, según Pfizer, no deben tomarse con Paxlovid. Entre ellos se encuentran algunos muy utilizados, como la lidocaína, la warfarina, el fenobarbital, la eritromicina, la hierba de San Juan, el fentanilo, la metadona, el midazolam y la prednisona.
Los resultados del estudio que aparecen en el comunicado de prensa estadounidense del 5 de noviembre de 2021 de Pfizer se basan en análisis estadísticos "por intención de tratar". Estos no son en absoluto rigurosos.
Si busca lo que significa "intención de tratar", verá que se basa en asumir que los sujetos del estudio recibieron el tratamiento, lo hayan hecho o no. Muchos artículos sobre este enfoque lo consideran sólido. Pero objetivamente no lo es en absoluto (empecé a fijarme en los análisis por intención de tratar en los estudios de investigación médica hace al menos 20 años; eran, y siguen siendo, por lo que sé, una forma popular de evitar la información honesta sobre los efectos y la eficacia de los medicamentos que se prueban).
Y para que quede claro, el estudio de Pfizer no se detuvo ahí: sus análisis con intención de tratar utilizan un enfoque "modificado". Específicamente incluyen, por ejemplo, a las personas "que al inicio del estudio no recibían ni se esperaba que recibieran el tratamiento anti-Covid-19 con el mAb [anticuerpo monoclonal]".
No se pueden inventar estas cosas.
Espero sinceramente que los empleados que, entre bastidores, se oponen a la presión para que se administre Paxlovid a muchas personas, se impongan.
Rosemary Frei
(Fuente: https://www.rosemaryfrei.ca/; traducción: https://es.sott.net/)
Suscribirse a:
Enviar comentarios (Atom)















No hay comentarios:
Publicar un comentario